Voyage au coeur du verre et de sa coloration.
2 participants
Page 1 sur 1
 Voyage au coeur du verre et de sa coloration.
Voyage au coeur du verre et de sa coloration.
En cours de recherche sur le fameux bleu de certains vitraux de la cathédrale de Chartres, il m'a semblé nécessaire de creuser certaines bases sur le verre, utiles pour ne pas décrocher. Elles sont communes à tous les sujets vitraux, donc mieux valait créer un sujet à part.
SOMMAIRE :
Silice, silicium, quartz ...
Coloration naturelle du quartz. Améthyste, citrine, amétrine, quartz fumé, quartz Morion, quartz hématoïde ...
Les fondants.
Un choix de vidéos sur la fabrication du verre.
La transformation du sable en verre suivie en temps réel.
La transformation du sable en verre suivie en temps réel (2)
Le verre, solide non cristallin amorphe.
Créations naturelles de verre : Fulgurite et obsidienne.
Fusion de la silice pure cristallisée.
Le tétraèdre de base de la silice et des silicates.
L'olivine.
Les oxygènes "pontants" et "non pontants" de la silice du verre.
Comment agissent les fondants ?
Comment agissent les stabilisants ?
Analyse des vitraux au spectromètre Raman.
Dernière édition par Northman le Ven 9 Déc 2016 - 19:41, édité 20 fois

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Silice, silicium, quartz ...
Silice, silicium, quartz ...
Le composant principal du verre, et donc en particulier de celui des vitraux, est la silice, SiO2, dioxyde de silicium. On le voit dans le tableau ci-dessous, concernant les verres modernes :

La silice représente 71,65% de la composition du verre à glace, 72,6% du verre à vitre et 72,62% du verre à bouteille blanche.
Après l'oxygène, le silicium est le second élément le plus abondant de l'écorce terrestre :
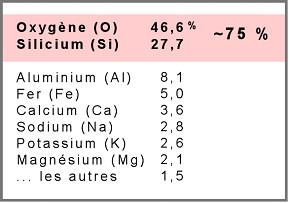
Sous forme cristalline, la silice donne entre autres le quartz, roche parfois translucide :

Structure cristalline du quartz :
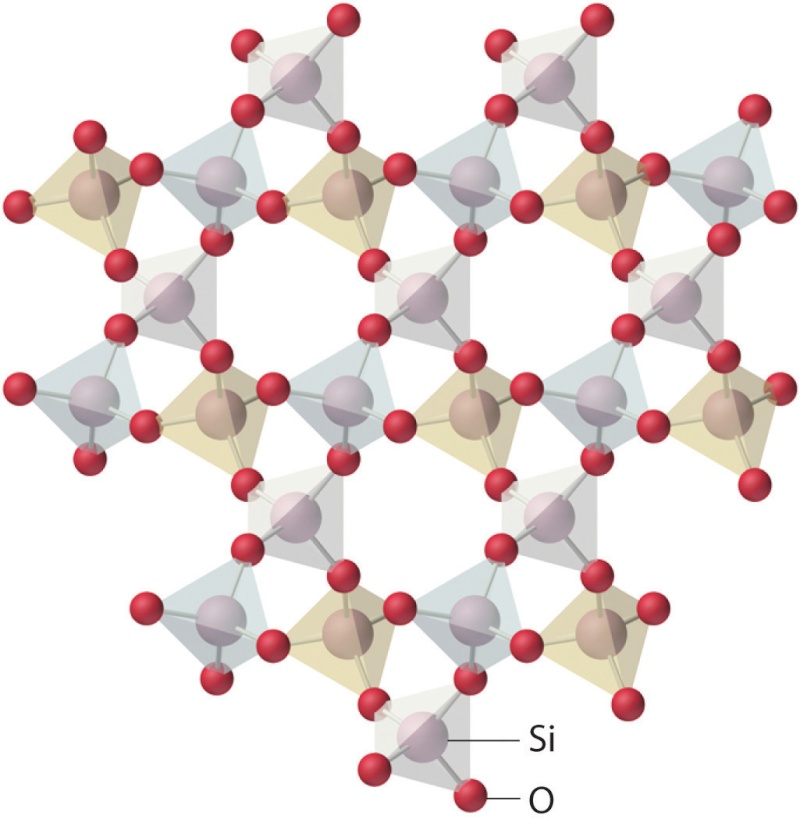
Au sein de la structure ci-dessus, chaque atome de silicium (Si, en gris) est relié à quatre atomes d'oxygène (O, en rouge).
Et chaque atome d'oxygène est relié à deux atomes de silicium. Les bâtonnets reliant les atomes de silicium aux atomes
d'oxygène représentent des liaisons chimiques dites de covalence, dans lesquelles il y a mise en commun d'électrons.
Dernière édition par Northman le Jeu 17 Mar 2016 - 7:41, édité 2 fois

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Coloration naturelle du quartz. Améthyste, citrine, amétrine, quartz fumé, quartz Morion, quartz hématoïde ...
Coloration naturelle du quartz. Améthyste, citrine, amétrine, quartz fumé, quartz Morion, quartz hématoïde ...
C'est très vraiment intéressant pour faire ensuite le parallèle avec la coloration des vitraux : Le quartz peut être naturellement coloré. En voici différentes déclinaisons.
La liste n'est pas exhaustive :
AMETHYSTE :
[/url]
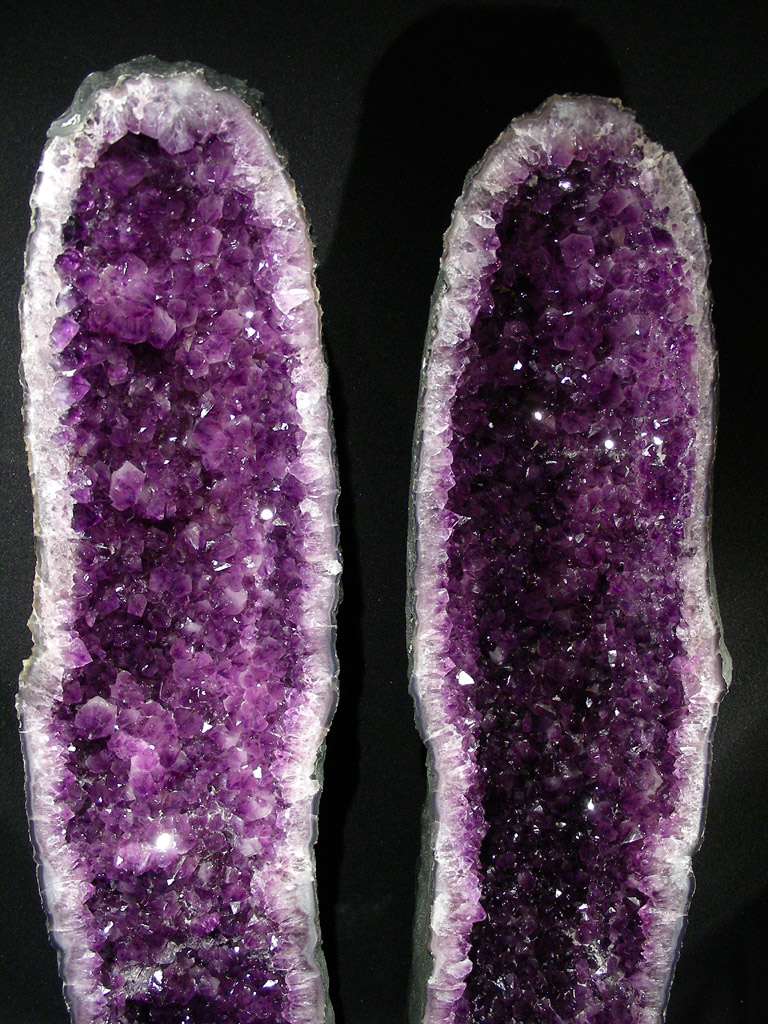
" L'améthyste dont le nom vient du grec amethystos : qui combat l'ivresse, cette pierre servant d'amulette contre l'ivrognerie ! C'est, en effet, dit la légende, le dieu Bacchus qui aspergea le cristal de son vin ce qui le colora. Ce cristal était le résultat de la transformation d'une nymphe importunée par ce dieu…et qui, ainsi put lui échapper.
Le fer sous forme Fe2O3 [oxyde ferrique] peut atteindre 0,25% dans les formes sombres. L'améthyste se décolore vers 400 degrés. Le fer remplace les atomes de silicium [quelques atomes de silicium, une infime fraction] dans le réseau. On aperçoit les zones de coloration en chevrons avec des angles de 60 et 120 degrés si on regarde à la loupe. La valeur de l'améthyste est proportionnelle à sa teinte.
On la retrouve sur les couronnes des rois et surtout sur les anneaux des évêques depuis 610 (et sur ordre du Pape !). On en trouve au Brésil, au Mexique, dans les Alpes et en Auvergne où elles furent exploitées du XVIII ème au XX ème siècle."
Ce qui est frappant, c'est la très faible quantité de fer ( 0,25% seulement !) donnant une coloration violette soutenue du quartz.
Source : Un article de Claire König, enseignante en sciences naturelles, que j'ai déjà croisée lors d'une recherche Internet sur les grès de Collonges-la-Rouge :
http://www.futura-sciences.com/magazines/terre/infos/dossiers/d/geologie-coeur-silice-silex-wafer-567/page/3/

CITRINE :
Et maintenant la citrine, quartz coloré en jaune, ici d'origine naturelle :


" La citrine teintée en jaune, beaucoup plus rare que l'améthyste, elle contient seulement 0,02% d'oxyde de fer. Elle présente les mêmes qualités que l'améthyste, et les citrines foncées sont souvent des améthystes chauffées !". Même source.
AMETRINE :
L'amétrine, combinaison d'amétyste et de citrine dans le même cristal :

"... une spécialité bolivienne, est un cristal très à la mode maintenant. L'aspect bicolore de la gemme est plus percutant sur une pierre taillée. Les Amétrines de la mine Anahí (Bolivie) : La mine Anahí est le principal producteur d'amétrine naturelle au monde mais pendant des années la production resta dans le flou compte tenu de l' extraction dans une réserve naturelle et les pierres allaient au Brésil vu sa proximité .La production est estimée à 10 t/an. L'exploitation se trouve à la base d'une colline (au nord des Mts Tapia) de 200 m surplombant les zones inondées du Pantanal. C'est le fer dont la concentration dépasse 40 ppm qui est à l'origine des couleur."
On parle ici en ppm, parties par million. 100 ppm, c'est 0,01% ! C'est donc vraiment en concentrations infimes que le fer peut colorer le quartz.
Même source.
"Améthyste et citrine sont deux déclinaisons de la famille des quartz. Un traitement thermique à 350° puis à 500° transformera une améthyste en une citrine. Les traces de fer Fe4 qui donne sa couleur violette à l’améthyste se transformant en oxyde de fer, Fe3 qui donne sa couleur jaune aux citrines (pour faire simple). L’amétrine présente naturellement des traces de ces deux déclinaisons d’oxyde de Fer qui engendrent la polychromie d’un même cristal."
Source.
DU QUARTZ FUME AU QUARTZ MORION :


Là Claire König ne précise pas la nature des éléments traces qui donnent la coloration du quartz fumé et du quartz Morion, ni leurs concentrations, plus fortes dans le quartz Morion que dans le quartz fumé. D'autres sites mentionnent des sels d'aluminium plus où mois irradiés naturellement par le granite environnant, mais sans donner de détails scientifiques, ni de concentrations en ppm ou en %. Du coup j'ai approfondi la recherche et suis tombé sur ce résumé d'article scientifique en anglais. Du point de vue scientifique on passe à un niveau supérieur, mais il y a des informations très intéressantes à extraire, ce que je ferai après citation complète du résumé de l'article :
"Abstract :
Color-enhancement investigations without using heating treatment from dull or pale to ideal saturation and/or changes to the formation of the rarer attractive colors are widely conducted to revalue abandoned gem material sources in the world. Such an investigation is carried out on pale or dull purple-colored amethyst and smoky-colored morion samples, which are two important gem species of the crystalline quartz (SiO2) mineral that are currently abandoned in natural deposits in Turkey because of their unattractive coloration. The results of color enhancements observed on these samples, after irradiation with artificial gamma, neutron and beta beams, were examined by comparing with samples with the ideal color saturation and also with colorless samples, using optical absorption (OA) and radioluminescence (RL) spectroscopy. The ICP-AES analyses reveal that the main impurity elements of over 100 ppm in abundance in these quartz species are aluminum, iron and titanium for amethyst, and aluminum, iron, titanium and manganese for morion.The OA spectra indicate that vivid purple coloration of amethyst is due to the transmittance at about 395–420 nm band gap as a result of absorbance peaks at 375, 480 and 530 nm. These absorbances may be related to the unusual oxidized small proportions of certain impurity ions, after being exposed mainly to gamma irradiation, such as Al(IV) from the total aluminum, Ti(V) from the total titanium and Fe(IV) from the total iron, respectively. However, the RL spectroscopy of amethyst samples before and after they were exposed to artificial gamma, neutron and beta radiation beams demonstrates that the ions most affected by irradiation are Fe(IV) first and Al(IV) and Ti(V) second, and these ions represent the RL peaks at 600, 720 and 495 nm, respectively. The OA spectra indicate that dark smoky coloration in morion is due to a lack of transmittance at the visible region as a result of the absorbance peaks at 375, 450–490, 620 and 730 nm. These absorbances also may be related to the unusual oxidized small proportions of certain impurity ions by irradiation, such as Al(IV) from the total aluminum, Ti(V) from the total titanium and Mn(III) from the total manganese, respectively. In addition, the buoyancies of these absorbance peaks in the visible region produce the color hues between light smoky and dark smoky colorations in morion samples. These oxidized ion states are more resistant and stable against environmental destructive conditions in comparison with amethyst. Thus, the dark smoky coloration of morion becomes dull or pale after relatively longer periods. But, the RL spectroscopy of morion before and after being exposed to gamma, neutron and beta irradiation beams demonstrates that the most induced ions from the irradiation are Mn(III) and Al(IV) first and Ti(V) second. These ions represent the RL peaks at about 400, 720 and about 500 nm, respectively."
Radiation Effects and Defects in Solids: Incorporating Plasma Science and Plasma Technology. 2010. Amethyst and morion quartz gemstone raw materials from Turkey: color saturation and enhancement by gamma, neutron and beta irradiation
Source : http://www.tandfonline.com/doi/abs/10.1080/10420150.2010.489611
Cet article scientifique nous confirme que les éléments-traces qui colorent le quartz y sont très faiblement concentrés. Ici, on commence à les prendre en compte à partir de 100 ppm, donc 100 parties par million, qui correspondent à 0,01%, nous l'avons vu plus haut. Il s'agit bien d'éléments traces.
Les principaux éléments traces de l'améthyste sont l'aluminium, le fer et le titane. Comme dans l'eau ferrugineuse, il n'y a donc pas que le fer.
Les principaux éléments traces du quartz Morion sont l'aluminium, le fer, le titane et le manganèse.
Très important, on a une explication scientifique de la coloration violette soutenue de l'améthyste, fondée sur les différentes longueurs d'ondes de la lumière naturelle, exprimées en nanomètres dans cet article (nm). Un petit rappel sur le spectre visible de la lumière naturelle. Aux différentes couleurs correspondent différentes longueurs d'ondes :
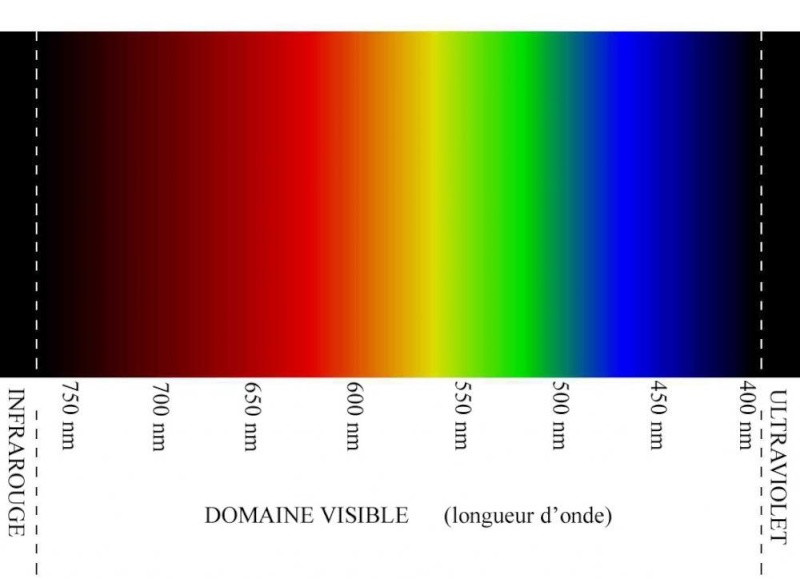
L'améthyste laisse passer les longueurs d'ondes dans une bande passante allant de 395 à 420 nm : On est effectivement en plein dans la partie violette du spectre. L'améthyste comporte des pics d'absorption - elle ne laisse donc pas passer ces fréquences lumineuses, elle les "filtre"- autour de 600, 720 et 495 nm, correspondant respectivement au fer, à l'aluminium et au titane présents en quantités infimes dans les cristaux. Je les ai représentés - ces pics d'absorption- en blanc. Ces raies blanches correspondent donc au maximum de chaque bande d'absorption, ce qui signifie que les fréquences lumineuses sont absorbées de chaque côté, mais avec une intensité décroissante quand on s'éloigne du pic :
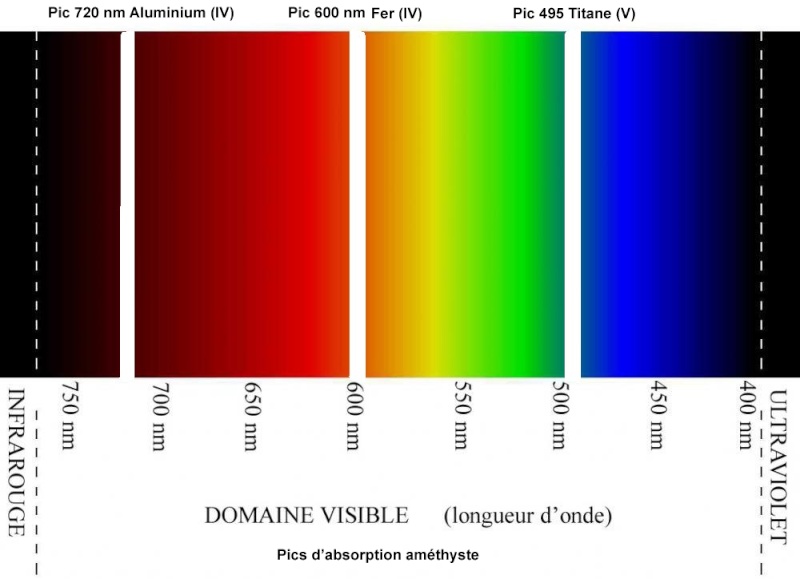
La couleur de l'améthyste correspond donc aux longueurs d'ondes non absorbées par les trois éléments traces principaux contenus dans les cristaux. Il n' a donc pas que le fer qui explique la coloration violette, même si son pic d'absorption centré sur 600 nm est le principal des trois, dans le rouge et l'orange. On est au cœur du phénomène de la couleur. En quantités infimes, un élément trace présent dans le cristal de quartz peut donc absorber une bande de fréquences lumineuses bien précise, centrée sur un pic d'absorption.
Pour le quartz Morion les éléments traces les plus impliqués dans la coloration sont le manganèse -ions Mn(III)- , et l'aluminium -ions Al(IV), secondairement le titane - ions Ti(V)-. Leurs pics d'absorption respectifs sont autour des longueurs d'ondes de 400, 720 et 500 nanomètres. La grosse différence avec l'améthyste, c'est le manganèse principal à 400 nm pour le Morion alors qu'on avait le fer principal à 600 nm pour l'améthyste. Les bandes d'absorption du quartz Morion - et du quartz fumé quand les absorptions sont moins intenses- :

QUARTZ HEMATOÏDE :



Ici c'est la présence d'hématite, oxyde de fer sous forme Fe2O3, ou de limonite FeO(OH)·nH2O - encore des oxydes mais aussi hydroxydes de fer - qui donnent la coloration rouge : Le fer n'y est donc pas dans le même état chimique que dans l'améthyste où il absorbe le rouge-orangé (pic d'absorption à 600 nm). Je n'ai pas trouvé pour le moment d'ordre de grandeur en ppm ou % de la concentration de ces oxydes de fer dans le quartz pour donner cette magnifique coloration.

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Les fondants.
Les fondants.
Le verre ordinaire, est-ce seulement du sable fondu?
"Le verre peut être obtenu par fusion d'un sable de silice tel le «sable de Fontainebleau». La silice est en effet le composé indispensable pour faire du verre. C'est le «formateur de verre». Mais sa température de fusion très élevée, environ 1750 °C, rend la fabrication particulièrement difficile et onéreuse avec de la silice pure. On ajoute donc des «fondants», tels que la soude, la potasse ou la chaux, qui se combinent à la silice et abaissent sa température de fusion. Par exemple, avec 20% d'oxyde de sodium, la silice fond dès 800°C, et l'on peut alors couler le verre à 1000°C."
http://www.larecherche.fr/idees/back-to-basic/verre-01-10-2004-86298
Les fondants utilisés ont varié dans le temps et l'espace, comme le montre ce tableau extrait de la thèse de doctorat en physique-chimie d'Aurélie Tournié ( Université Pierre et Marie Curie) :
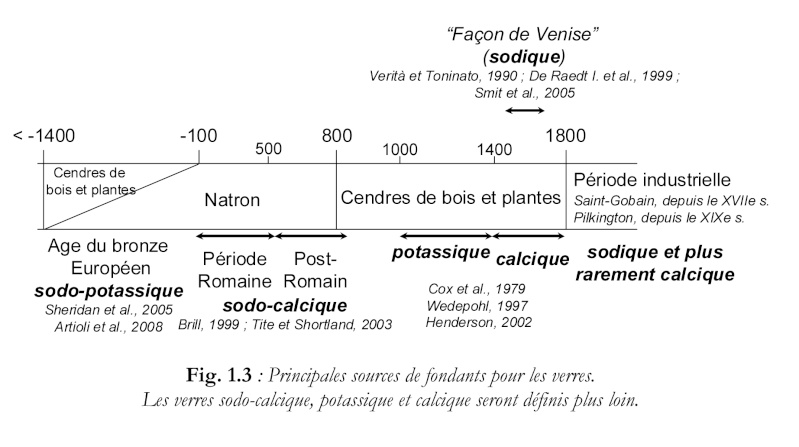
Source : http://www.glvt-cnrs.fr/ladir/pages/theses/These_Aurelie_Tournie.pdf
On voit par exemple que de 1000 à 1400, les fondants médiévauxx étaient des cendres de bois et/ou de plantes, et étaient potassiques. Pour la période industrielle, le fondant dominant est la soude.
Pour le natron, voir seconde vidéo du post ci-dessous :
Dernière édition par Northman le Dim 13 Mar 2016 - 11:18, édité 2 fois

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Un choix de vidéos sur la fabrication du verre.
Un choix de vidéos sur la fabrication du verre.
Un peu de détente avec ce reportage sur la fabrication actuelle Archéologie, Egypte. CNRS :
de cristal, émission "C'est pas sorcier" :
Ici, le fondant est la soude et le consolidant l'oxyde de plomb
( minium) ce qui caractérise le cristal.
Plus dans notre sujet, à la verrerie de Saint-Just, pour les vitraux. Très intéressants reportages. Il y est question entre autres de
Matisse, dans le premier :
Sur Matisse et les vitraux de la chapelle de Vence, voir ici :
https://lartcommeonlaime.forumactif.org/t148-point-sur-le-vitrail-contemporain-en-france#2076

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 La transformation du sable en verre suivie en temps réel.
La transformation du sable en verre suivie en temps réel.
La transformation du sable en verre n’est pas complètement comprise. Pour la première fois, des chercheurs français ont suivi le processus en temps réel et à l’échelle microscopique.
Article de "Pour la Science" du 03.05.2012, par Sean Bailly :
"Les premières fabrications de verre datent de 3 000 ans avant notre ère, en Mésopotamie et en Égypte. Les techniques se sont perfectionnées au cours des siècles, l’enjeu majeur étant d’éliminer les cristaux non fondus et les bulles. L’industrie utilise des mélanges de sable et de carbonates, qui existent à l'état fondu à environ 1 050 °C, mais si on n’élève pas plus la température, certains grains de sable ne fondent pas et créent des imperfections dans le verre. On remédie à cette difficulté en portant l’ensemble à 1 500 °C et en laissant le tout dans le four pendant plusieurs jours. Ce procédé élimine les défauts, mais est très coûteux en énergie. Améliorer la technique passe par une compréhension plus fine des processus microscopiques à l’œuvre. Emmanuelle Gouillart, du Laboratoire Surface du verre et interfaces du CNRS/Saint-Gobain à Aubervilliers, et ses collègues ont suivi l’évolution au sein des matières premières du verre grâce à la tomographie aux rayons X.
Les principales matières premières du verre sont du sable – du dioxyde de silicium ou silice – et les carbonates de calcium et de sodium. Le carbonate de sodium agit comme un fondant : il abaisse la température de fusion du mélange – la silice seule fondrait à 1 750 °C. Le carbonate de calcium apporte une protection chimique au verre et le protège en particulier des effets de l’eau. Les interactions entre les cristaux de silice et de carbonates jouent un rôle crucial pour expliquer les différents phénomènes au sein du mélange conduisant à l’apparition des défauts ou à leur absence. À Grenoble, l’ESRF, l’Installation européenne de rayonnement synchrotron, offre les moyens techniques pour étudier en temps réel la transformation du sable en verre. Un faisceau intense de rayons X a été utilisé pour obtenir des images en trois dimensions du mélange. E. Gouillart et ses collègues ont ainsi pu suivre les mouvements des grains dans le mélange, leurs modifications microstructurales et la formation de nouveaux composés lors de réactions, avec une résolution de 1,6 micromètre.
En chauffant progressivement le mélange de silice et de carbonates, on observe divers phénomènes. Au-dessous de 750 °C, au contact de la silice, les cristaux de carbonate de sodium se déforment pour épouser la forme des cristaux de silice. Une réaction entre le sable et le carbonate de sodium (réaction de décarbonatation) est à l’origine de la formation de deux types de silicates de sodium. Simultanément, si un carbonate de calcium est en contact avec un carbonate de sodium, ils forment un carbonate double. Isolé, le carbonate de calcium se dissocie en chaux et en dioxyde de carbone. À partir de 810 °C, les premiers cristaux fondent. La fusion se fait à différentes températures en fonction des éléments en contact. Par exemple, les grains de silice qui ne sont pas entourés de silicate de sodium sont probablement les éléments les plus difficiles à faire fondre – ils sont toujours solides à 900 °C – et peuvent créer des défauts dans le verre. Des pistes pour améliorer la fabrication du verre ? "
La vidéo, réalisée par Emmanuelle Gouillart et ses collègues, illustre les possibilités de suivi en trois dimensions de la tomographie aux rayons X :
"L'interaction d'un grain de carbonate de sodium (en rouge) avec deux grains de silice (bleu et jaune) [Sur la vidéo, le sable est en jaune, pas en bleu] est montrée à différentes températures. Le silicate de sodium (en blanc) formé se dépose sur les grains de silice :"

Source : http://www.pourlascience.fr/ewb_pages/a/actu-la-transformation-du-sable-en-verre-suivie-en-temps-reel-29759.php
Dernière édition par Northman le Mar 15 Mar 2016 - 10:10, édité 3 fois

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 La transformation du sable en verre suivie en temps réel (2)
La transformation du sable en verre suivie en temps réel (2)
Sur le début de la vidéo, les trois couleurs correspondent à des grains de trois matières différentes, trois constituants de base du mélange qui deviendra verre par fusion :
En jaune : Gains de sable ( donc très riches en SiO2, silice) allant de 160 à 200 microns.
En rouge : Grains de carbonate de sodium ( Na2CO3 : Na étant le sodium, natrum en latin, d'où aussi natron, voir plus haut) allant de 250 à 320 microns. Ce sont les plus gros grains. C'est le fondant, qui nous intéresse tout particulièrement. Rappelons qu'à l'époque médiévale, le fondant était la potasse K2CO3, K étant le potassium, kalium en latin.
En bleu : Grains de carbonate de calcium ( CaCO3) allant de 80 à 100 microns. Ce sont les plus petits grains. C'est le stabilisant du verre.

Sur cette séquence de la chauffe allant croissant de 730° à 760° Celsius, on a l'évolution des grains vue du dessus, en haut, et vue de côté, en bas :

Je pense qu'il y a une erreur dans la légende de cette illustration de l'article scientifique. Les grains bleus ne sont pas des grains de silice, mais toujours des grains de carbonate de calcium. Au cours de cette séquence, on a une nette réduction de la taille du grain de carbonate de sodium, donc du fondant, représenté en rouge. Ce grain de carbonate de sodium rétrécit nettement, fond le premier, au profit de l'apparition de grains blancs qui, au moins sur le grain de silice, représentent du silicate de sodium. C'est donc qu'il y a eu transfert d'atomes de sodium du carbonate de sodium vers la silice pour former du silicate de sodium. C'est cette réaction chimique qui va permettre l'abaissement de la température de fusion de 1750° Celsius pour la silice pure à environ 1050° Celsius pour le mélange silice-fondant, le four étant cependant maintenu à 1500° sur une longue durée pour venir à bout des grains de sable les plus réfractaires.
Cette interaction chimique du sodium - ou du potassium- avec la silice est fondamentale. Elle n'est pas seulement utile pour abaisser la température de fusion : Les atomes de sodium ou de potassium insérés dans le maillage de silice contribuent à donner ses propriétés essentielles au verre, dont la transparence.
Dernière édition par Northman le Mar 15 Mar 2016 - 11:08, édité 1 fois

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Le verre, solide non cristallin amorphe.
Le verre, solide non cristallin amorphe.
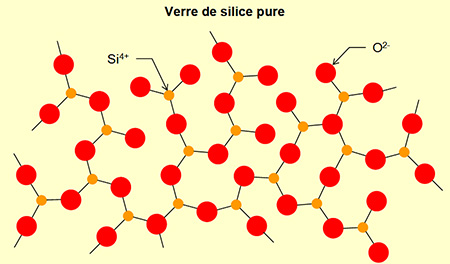
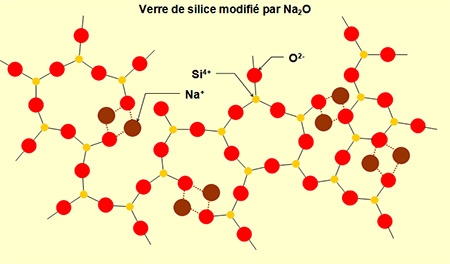
Nous reviendrons un peu plus loin sur le mode d'action des fondants. Nous le comprendrons mieux en passant d'abord par la structure moléculaire du verre refroidi. En voici un exemple de représentation schématique en 3D. On zoome encore fortement pour passer à l'échelle des molécules et des atomes :
Source : http://www.nanosciencenet.org/smno/Chapitre%207.pdf
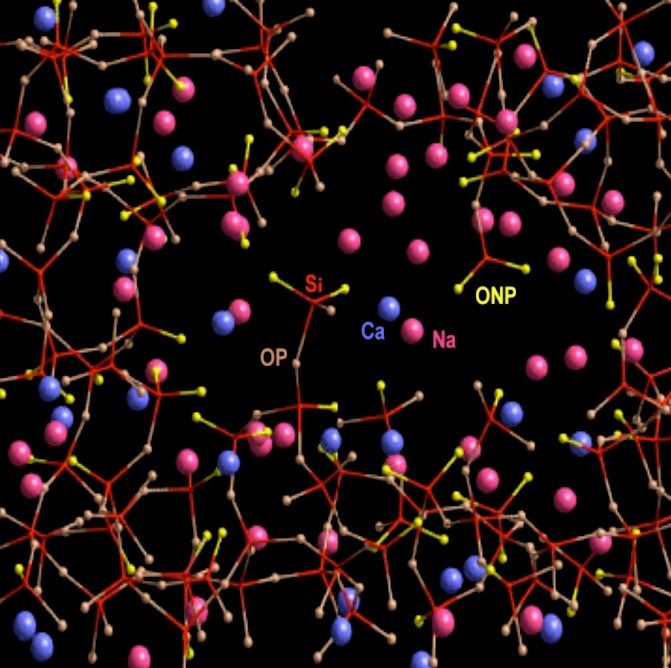
Les bâtonnets reliant les atomes de silicium (non représentés afin d'alléger le schéma, situés au centre des sous-structures à quatre bâtonnets rouges) aux atomes d'oxygène (jaunes ou gris) représentent un type de liaison chimique appelé liaison de covalence. Les atomes de sodium (roses) ou de calcium (bleus) "flottent" dans le verre sans être reliés aux atomes d'oxygène ou de silicium par covalence : Ils ne sont pas reliés par des bâtonnets. En fait ils ne "flottent" pas complètement, car il existe un autre type de liaison, plus faible, que nous verrons plus loin. La structure du verre est dite amorphe et non cristalline, alors que dans la structure cristalline de la silice, tous les atomes sont reliés par covalence :
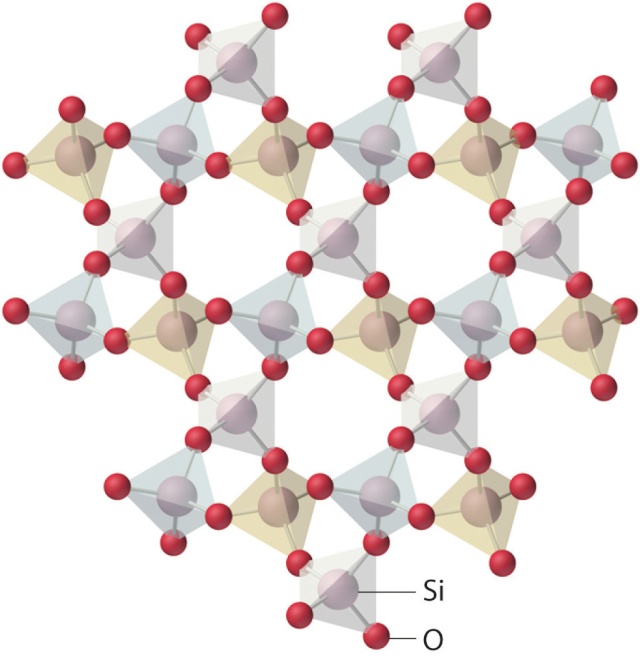
La structure non cristalline du verre présente des lacunes dans lesquelles "flottent" des atomes de sodium - ou de potassium selon le fondant- ainsi que des atomes de calcium. C'est grâce à ces lacunes que le verre est transparent, alors que la silice, cristalline par exemple sous forme de quartz, est tout au plus translucide, comme nous l'avons vu plus haut.
Comparaison de la structure cristalline de la silice et de la structure amorphe et non cristalline du verre :
Pour mieux comprendre la suite, un petit cours très clair sur les molécules polaires :
La silice est elle aussi polaire, et c'est cette polarité qui rend possible l'action des fondants. Nous y reviendrons après un petit intermède ... fulgurant.

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Créations naturelles de verre : Fulgurite et obsidienne.
Créations naturelles de verre : Fulgurite et obsidienne.
Sans fondant, nous avons vu qu'il faut monter très haut en température pour fondre le sable, au-dessus
de 1750°. La nature peut faire cela. Spectaculaire et fulgurant, dans tous les sens du terme :

Ce minéral comportant du verre naturel est appelé fulgurite. Il est créé par l'impact des éclairs orageux sur du sable :
La nature artiste. Une des ces créations fulgurantes mise à nu :


Un autre verre naturel, l'obsidienne :


Là, le "four" est volcanique, ou plus exactement magmatique, en profondeur sous les volcans. Voici le mécanisme de formation :
" - L’obsidienne est un verre naturel, elle est produite lors d’une émission de lave riche en silice contenant très peu d’eau (- de 3 %). Au moment de sa sortie du volcan, elle subit un refroidissement très rapide qui gèle les mécanismes de cristallisation. "C’est comme un morceau de lave figé lors de sa sortie du volcan."
- L’Obsidienne se forme si rapidement que les atomes sont incapables de s'organiser en structures cristallines. Le résultat donne un verre volcanique avec une texture uniforme sans heurt. En raison du manque de structure cristalline, l’obsidienne à des arrêtes tranchantes et des lames extrêmement fines.
- C’est un matériel minéral naturel qui à une composition trop complexe pour être composée d’un simple minéral. Cependant l’obsidienne se compose principalement de SiO2 (dioxyde de silicium), généralement de 70 % ou plus."
Source : http://mexico-obsidienne.com/formation-obsidienne.html
C'est bien la silice qui est le vitrifiant, et 70%, c'est proche du pourcentage de silice que nous avons vu en début de sujet pour différents verres créés par l'homme : " La silice représente 71,65% de la composition du verre à glace, 72,6% du verre à vitre et 72,62% du verre à bouteille blanche."
https://lartcommeonlaime.forumactif.org/t156-quelques-bases-sur-le-verre-et-sa-coloration#2080
L'obsidienne est issue d'un magma riche en silice, donc d'un type de volcan particulier. Ces magmas dits rhyolitiques ont des températures comprises entre 650° et 800°C, bien inférieures aux 1750°C requis pour la fusions de la silice pure, ce qui signifie que dans les 30% restants de la composition de l'obsidienne, certains composants jouent le rôle de fondants. Effectivement les magmas rhyolitiques sont riches en potassium (K) et en sodium (Na) :
Source : http://www.geolalg.com/chabou/cours2.pdf

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Fulgurites, suite.
Fulgurites, suite.
Jean-Yves Amir a écrit:Incroyable!
Oui, c'est la plus spectaculaire des photos de fulgurites que j'ai trouvée pour le moment. Je pense qu'elle était initialement souterraine et qu'elle aurait été mise à nu par l'érosion, en particulier par le vent (?). Et à l'intérieur, du verre ! En une fraction de seconde, l'éclair fait monter la température du sable des environs immédiats de son parcours largement au-dessus de la température de fusion de la silice, 1750° environ, donc la silice fond, et encore très rapidement, une fois l'éclair passé, elle se refroidit, ce qui ne lui laisse pas le temps de se réorganiser en cristal et la laisse figée à l'état vitreux. Je trouve cela formidable. Fulgur, c'est éclair en latin... Fulgurite, pierre d'éclair.
Ce serait dans le désert de Lybie, en bord de mer Méditerranée. Cette fulgurite de grande taille résulte d'un éclair très puissant, produit par un cumulonimbus très développé. On imagine facilement une convection fortement amplifiée par le passage de l'air du dessus de la mer au dessus du désert, à la surface extrêmement chaude.
Dernière édition par Northman le Ven 18 Mar 2016 - 8:32, édité 1 fois

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Re: Voyage au coeur du verre et de sa coloration.
Re: Voyage au coeur du verre et de sa coloration.
En somme, c'est une sorte d'empreinte, ou de moulage même, de la foudre dans le sable.
Le sable a conservé la forme de l'éclair!
Mais on devrait pouvoir trouver ce genre de volume étrange sur toutes les plages!
Le sable a conservé la forme de l'éclair!
Mais on devrait pouvoir trouver ce genre de volume étrange sur toutes les plages!
 Fulgurites, suite.
Fulgurites, suite.
Oui, en cherchant bien dans le sable là où la foudre a frappé, et en creusant avec délicatesse... En fait, tu dois passer à côté ou au-dessus de la plupart des fulgurites sans les voir. La taille de la fulgurite dépend de la puissance de l'éclair, donc de l'intensité de l'orage. Comme je l'ai écrit plus haut, cette impressionnante fulgurite, celle que tu as reprise en citation, a été trouvée dans un secteur propice à des orages particulièrement violents. De plus, elle semble avoir été mise à nu probablement à cause du déplacement, par le vent, du sable qui l'entourait. On voit une dune de sable blanc plus loin sur la photo, type de dune typiquement déplaçable par le vent. Sur la première vidéo de mon post consacré aux fulgurites et à l'obsidienne, on voit que l'homme a l'oeil bien exercé et qu'il creuse pour mettre à jour une fulgurite de modeste taille, enfouie sous le niveau du sol comme elles le sont presque toutes. J'ai vu beaucoup d'autres photos avec des fulgurites nettement plus petites que le "monstre" de la fameuse photo.


"Les fulgurites sont de fragiles morceaux de verre naturel souvent cylindriques qui se produisent lorsque la foudre entre en contact avec une roche ou, le plus souvent, du sable. Un seul éclair délivre une telle énergie qu’il peut chauffer suffisamment la silice que l’on trouve dans le sable pour lui faire atteindre largement les 1800°C nécessaires à la faire fondre et à souder les grains de sables entre eux. Les fulgurites peuvent faire plusieurs centimètres de large et mesurer plus de 5 mètres de long ( Darwin avait noté qu’on en avait trouvé une en Angleterre de 9,1m de long, la plus longue préservée fait 4m ) et se trouver jusqu’à 15m sous la surface du sol."
Source : http://www.laboiteverte.fr/les-fulgurites-a-la-rencontre-entre-la-foudre-et-le-sable/

"Quand il y a fusion et refroidissement rapide, les conditions sont réunies pour la formation d'un verre, raison de plus quand la fusion et le refroidissement sont hyper-méga- giga immédiats. C'est notamment le cas des FULGURITES ou pierres de foudre.
Quand un éclair impacte le sable celui ci est instantanément fondu par une chaleur pouvant monter à 35 000°C pendant un très court instant : 1 / 1 000 000 ème de seconde. Le refroidissement est tout aussi brutal et il se forme un verre "pur" nommé "lechatelierite" ( Alfred Lacroix en 1915 avait honoré l'ingénieur des mines Le Chatelier). Ces cicatrices vitrifiées laissées par la foudre sur son passage peuvent atteindre plusieurs mètres comme cet exemplaire que j'ai vu au musée de Dresde en Allemagne. Dans la revue Minéraux et fossiles N°33 on montre une fulgurite belge de 8,4m découverte en 1955, à Zutendaal. C'est la plus grande d'Europe.
En Mauritanie, près de Nouakchot, ou dans le désert libyque en Egypte, on peut trouver des fragments d'une dizaine de centimètres pour un diamètre de 5 à 20 mm. Celles d' Egypte datent de 14000 à 16000 ans et témoignent d'un climat à l'époque très différent de celui actuel. Elle soutiennent donc l'hypothèse d'une évolution du climat compte tenu des peintures rupestres qui montre des animaux de climat subtropical certainement pas désertique.
Il n'est pas rare que la foudre frappe les sommets volcaniques et sur l'Etna (Montagnola et Silvestri), le chercheur Robert Clottchiatti a trouvé des fulgurites fondues dans un sable noir volcanique. (voir "les fulgurites et roches vitrifiées de l'Etna" Eur.J.Mineral 1990 2 ,479-494) Malheureusement cette fulgurite vue par l'orifice tombe en ruine, on voit cependant la partie interne vitrifiée."
Source : André Holbecq (encore un prof-de-SVT-passionné-qui-partage) sur : http://www.geoforum.fr/topic/4783-les-verres-naturels-obsidiennes-fulgurites-et-impactites/
Dernière édition par Northman le Mar 22 Mar 2016 - 12:37, édité 19 fois

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Fusion de la silice pure cristallisée.
Fusion de la silice pure cristallisée.
Sur cette animation, on voit bien la structure atomique en 3D du quartz. Les atomes de silicium sont représentés en bleu, d'oxygène en rouge. A la fin de cette petite vidéo, à partir de 0'51", on voit l'agitation des atomes au sein de la structure. Plus la température augmentera, plus cette agitation s'amplifiera. Ca n'est pas dans l'animation, mais aux alentours de 1750°C, l'agitation des atomes sera suffisamment forte pour briser les liaisons de covalence ( mise en commun d'électrons entre les atomes de silicium et d'oxygène) représentées par les bâtonnets : Ce sera la fusion.
Comment la présence d'atomes de sodium ou de potassium, issus de la soude ou de la potasse, les fondants, peut-elle considérablement abaisser la température de fusion de la silice, et donc faciliter la rupture de liaisons de covalence silicium-oxygène, Si-O ?

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
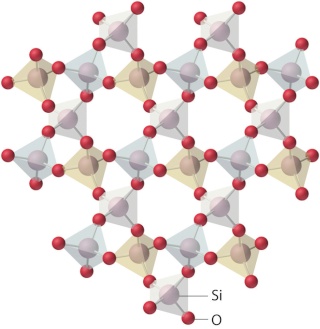
 Le tétraèdre de base de la silice et des silicates.
Le tétraèdre de base de la silice et des silicates.
Zoomons sur la structure atomique du quartz vue plus haut dans ce sujet :
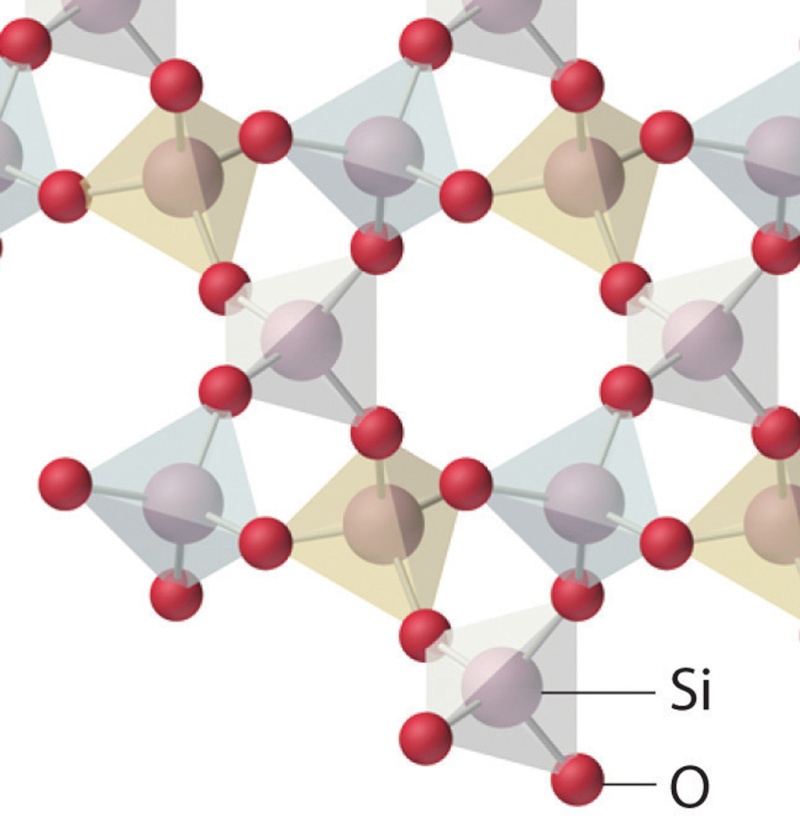
Les tétraèdres de base y sont représentés en couleurs transparentes : Un atome de silicium au centre, et un atome d'oxygène
sur chacun des quatre sommets du tétraèdre.
Voici une représentation chimique du tétraèdre de base de la silice et des silicates :

Un tétraèdre de base isolé n'est pas équilibré électroniquement, d'où les signes négatifs,
un par atome d'oxygène. Nous allons voir pourquoi, c'est important pour la suite.
Ce tétraèdre de base, puisqu'électroniquement déséquilibré, est un ion, l'ion silicate, (SiO4)4-
4- : Il lui manque quatre électrons, un par atome d'oxygène, pour être équilibré.
Il manque deux électrons à l'orbite périphérique de l'oxygène pour atteindre la stabilité, avec huit électrons sur l'orbite périphérique :
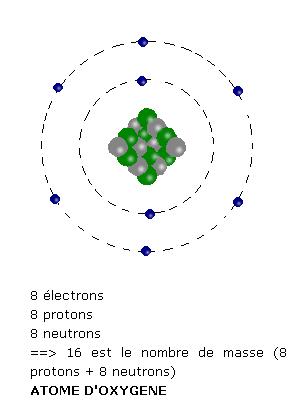
Il manque quatre électrons dans l'orbite périphérique pour obtenir la stabilité :
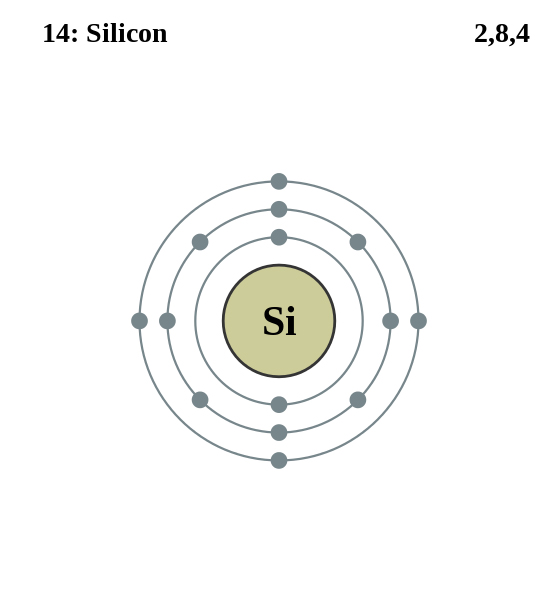
Dans le tétraèdre de base, chaque atome d'oxygène partage un électron de son orbite périphérique avec un électron de l'orbite périphérique du silicium. Ainsi se forment quatre liaisons de covalence, très solides, qui équilibrent l'orbite périphérique du silicium. Cependant, il manque encore un électron à chaque atome d'oxygène pour obtenir l'équilibre. D'où la charge quatre fois négative de l'ion silicate, tétraèdre de base.

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 L'olivine.
L'olivine.

La structure atomique de l'olivine se compose d'une part de tétraèdres de base, ions silicates, bien séparés les uns des autres :
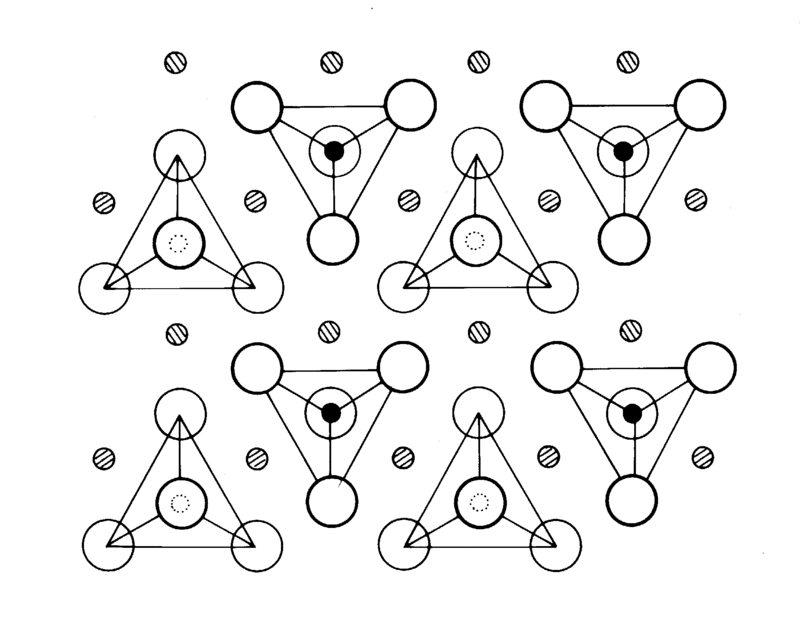
D'autre part viennent s'intercaler entre ces tétraèdres des ions positifs de fer et de magnésium, mieux représentés ici :

Pour mieux visualiser en 3D. C'est surtout le début de la vidéo
qui est intéressant pour nous, jusqu'à 1'33". Ils ont simplifié en
ne faisant pas apparaître les atomes de fer :
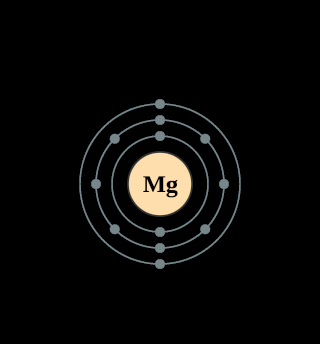
Ce qui nous intéresse surtout, ce sont les liaisons entre les cations* magnésium Mg++ ou fer Fe++ et les tétraèdres silicates.
Ce ne sont pas des liaisons de covalence : Sur les représentations, il n'y a pas de bâtonnets entre ces cations et les
atomes d'oxygène des ions silicates. Donc pas de mise en commun des électrons formant un nuage électronique autour des
deux atomes liés, mais "arrachage" complet des électrons du magnésium et du fer par les oxygènes des tétraèdres.
Ce sont des liaisons ioniques :
Les atomes de fer et de magnésium sont dans un état dit oxydé. Le fer est ici oxydé à l'état d'ion ferreux Fe++. Dans d'autres configurations atomiques que celle de l'olivine,
il peut encore perdre un électron et être oxydé à l'état d'ion ferrique Fe+++. C'est important à retenir car selon le degré d'oxydation le fer ne donne pas la même couleur
aux cristaux - on l'a vu pour l'améthyste- ou au verre.
Ces liaisons ioniques équilibrent la structure de l'olivine du point de vue des charges électriques. Chaque atome de fer ou de magnésium est donneur de deux électrons de son orbite
périphérique, d'où les notations Mg++ et Fe++, ce qui le met en liaison ionique avec deux atomes d'oxygène, appartenant à deux tétraèdres différents. Ceci explique la cohésion de
l'ensemble.
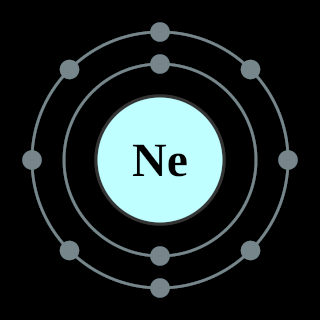
L'atome de magnésium est un donneur d'électrons. Pour tendre vers l'état stable du gaz noble le plus proche, le néon (Ne), il
lui faut perdre les deux électrons de sa couche périphérique :
Avec uniquement des ions Fe++ entre les tétraèdres silicates, le minéral est la fayalite :

Avec uniquement des ions Mg++ entre les tétraèdres silicates, le minéral s'appelle forstérite. Intéressante, la différence
de couleur avec la fayalite. Forstérite :

Globalement, l'olivine peut se situer n'importe où sur cet axe X, avec différentes
proportions possibles de Mg++ et de Fe++ :

* Cation : ion positif. Anion, ion négatif.

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
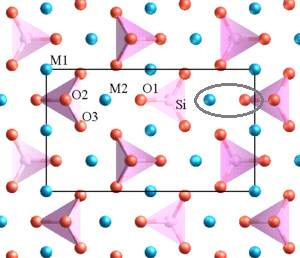
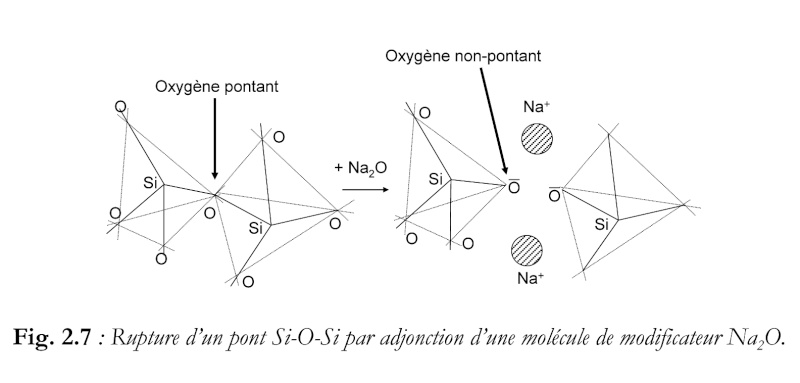
 Les oxygènes "pontants" et "non pontants" de la silice du verre.
Les oxygènes "pontants" et "non pontants" de la silice du verre.
Dans l'olivine, les ions magnésium Mg++ et fer Fe++ s'intercalent entre les tétraèdres silicates et, contrairement à ce que
l'on observe dans la silice, aucune liaison directe n'existe entre les tétraèdres de base. Sur la figure 3D ci-dessous du quartz,
j'ai entouré en rouge un exemple d'atome d'oxygène reliant deux tétraèdres par deux de leurs sommets, et souligné en noir
les liaisons de covalence silicium- cet oxygène. Cet atome d'oxygène forme donc un pont entre deux tétraèdres,
il est dit "pontant" :


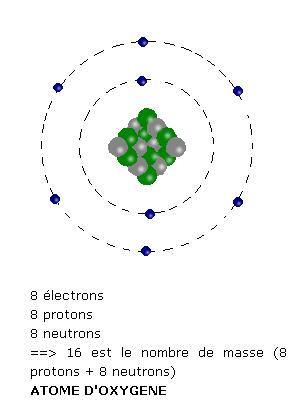

En reliant par covalence deux atomes de silice, l'atome d'oxygène réalise l'équilibre sur son orbite électronique périphérique, car la mise en commun d'un
électron avec chacun des deux atomes de silicium apporte à l'oxygène les deux électrons périphériques qui lui manquent pour assurer sa stabilité.
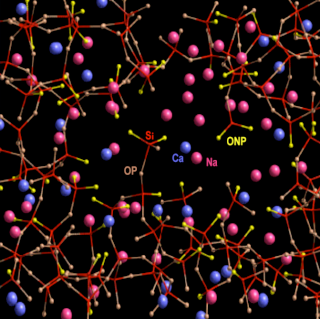
Revenons à la silice présente dans le verre sodo-calcique:
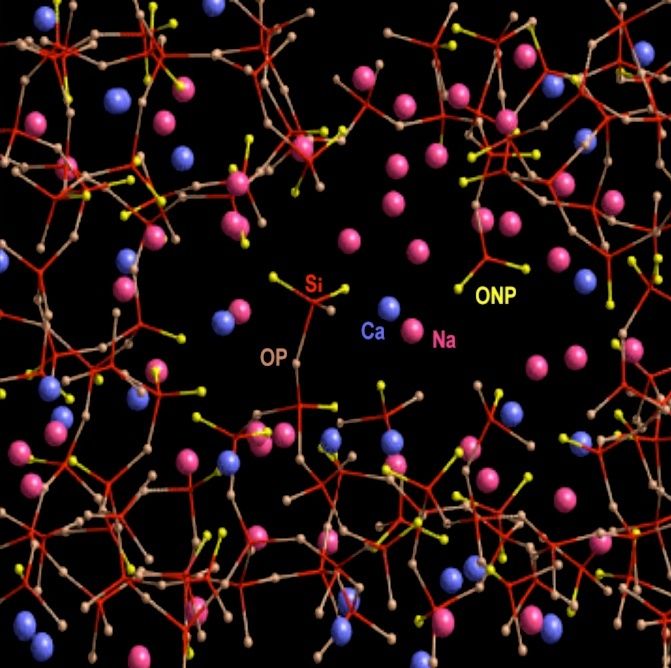
L'atome d'oxygène "OP" est un exemple d'oxygène pontant, en marron. L'atome d'oxygène "ONP" est un
exemple d'oxygène non pontant, en jaune.
Voici les éléments de cette structure atomique mi-ordonnée, mi-désordonnée du verre sodo-calcique. J'ai ajouté le
potassium (K) qui peut être utilisé à la place du sodium (Na) comme fondant :

Le sodium et le potassium, atomes actifs des fondants, sont tous deux monovalents, donc avec un seul électron sur la
couche périphérique :
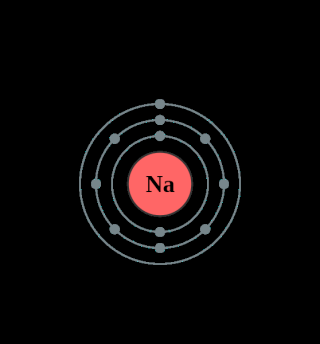
Le calcium, utilisé comme stabilisant, est divalent, donc avec deux électrons sur sa couche périphérique :
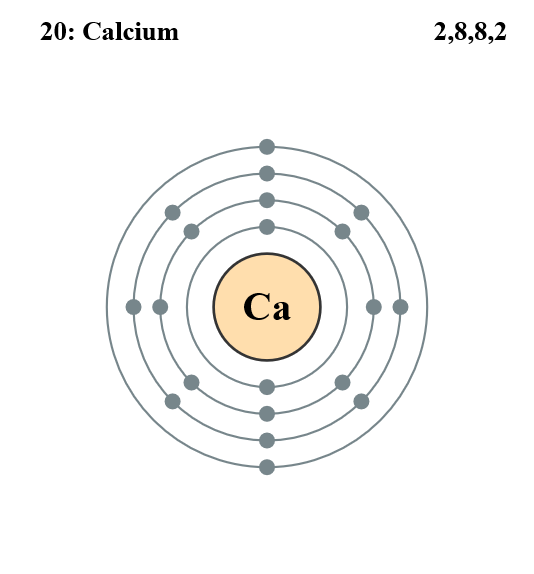
Nous allons voir pourquoi, c'est justement parce qu'il est divalent que le calcium a cette
propriété stabilisante du verre. Monovalents, le calcium ou le potassium ne peuvent avoir
cette propriété stabilisante.
Dernière édition par Northman le Lun 28 Mar 2016 - 12:01, édité 1 fois

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Comment agissent les fondants ?
Comment agissent les fondants ?
On ne peut comprendre le mode d'action des fondants qu'à l'échelle nanométrique.
Au niveau des oxygènes pontants de la silice, il n'y a pas d'angles de 180° :


Ceci confère à la molécule une polarité négative au niveau de l'oxygène pontant.
J'ai mis une vidéo plus haut sur les molécules polaires. Pour ceux qui voudraient
voir comment on détermine la polarité de molécules simples, voici un petit cours
complémentaire, avec accent bien connu :
Nous avions vu que dès 750°, le carbonate de sodium (ici en rouge), le fondant, commence à fondre :

"Le carbonate de sodium est un corps composé chimique minéral ayant pour formule Na2CO3 et correspondant à l'espèce
minérale naturelle dénommée la natrite. Il s'agit d'un sel de sodium de l'acide carbonique, il représente un des grands
produits polyvalents de la chimie moderne. Dans le langage courant, ce solide ionique, le plus souvent sous forme poudreuse,
et ses solutions aqueuses sont dénommés cristaux de soude et soude, du nom commun de cet ancien alcali minéral, utilisé
précocement dans l'industrie verrière antique [voir plus haut natron]".
Source ici.
Schéma moléculaire du carbonate de sodium :
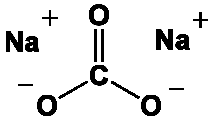
Dès 750°, le carbonate de sodium va commencer à fournir des cations sodium qui vont être attirés par les sites à polarité négative
de la silice. En se positionnant de part et d'autre d'un oxygène pontant, et avec l'apport d'un atome d'oxygène lui aussi fourni par
le carbonate de sodium, une des liaisons de covalence oxygène-silice du pont oxygène va céder, bien en dessous de 1750° C :

Les deux ions Na+ placés de part et d'autre de l'oxygène pontant agissent un peu comme une paire de ciseaux, à partir
de 760° environ. En langage plus scientifique, ils abaissent considérablement la température de fusion de la silice et sont
donc en fait catalyseurs de sa dépolymérisation.
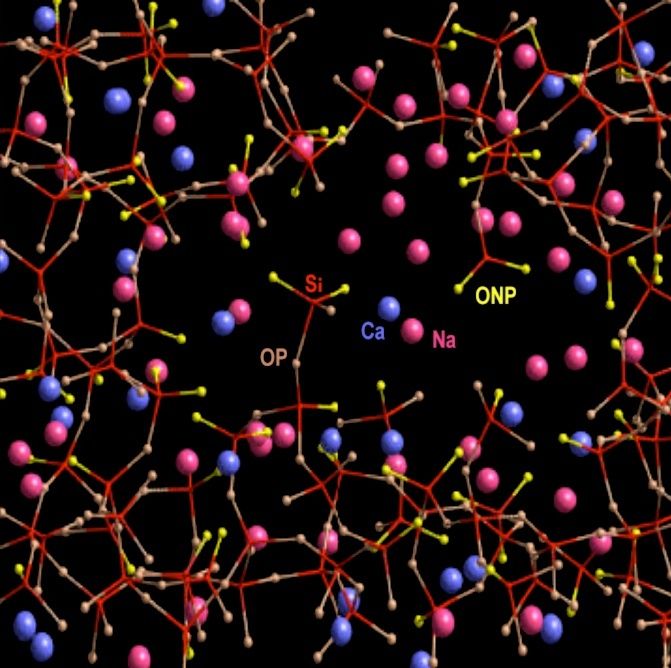
Illustration issue de la thèse d'Aurélie Tournié, page 44 :
Et ainsi placés dans les lacunes du réseau vitreux des brins de silice, à proximité des oxygènes devenus non pontants suite
aux ruptures des liaisons de covalence oxygène-silicium, assurant l'équilibre électrique des charges positives et négatives,
ils empêchent la silice de se re-polymériser, de se recristalliser lors du refroidissement de la pâte vitreuse. Ils ne 'flottent" pas
dans ces lacunes, mais sont maintenus en place par l'attraction des charges électriques négatives des oxygènes non pontants.
Dernière édition par Northman le Mar 29 Mar 2016 - 22:16, édité 5 fois

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Comment agissent les stabilisants ?
Comment agissent les stabilisants ?
Là aussi, seule l'échelle nanométrique nous permet de comprendre le mode d'action des stabilisants. Nous l'avons vu, les fondants fonctionnent grâce à leurs cations monovalents : Sodium Na+, ou potassium K+. Un seul électron sur leur orbite périphérique. Les stabilisants fonctionnent grâce à leurs cations divalents, calcium Ca++ dans notre exemple de verre sodo-calcique, ou plomb Pb++ pour le cristal. Ces cations divalents ont la propriété de se lier par attraction électrique à deux oxygènes non pontants de deux brins de silice différents du réseau vitreux. Ainsi, sans pour autant établir une liaison de covalence, ils stabilisent le réseau vitreux :
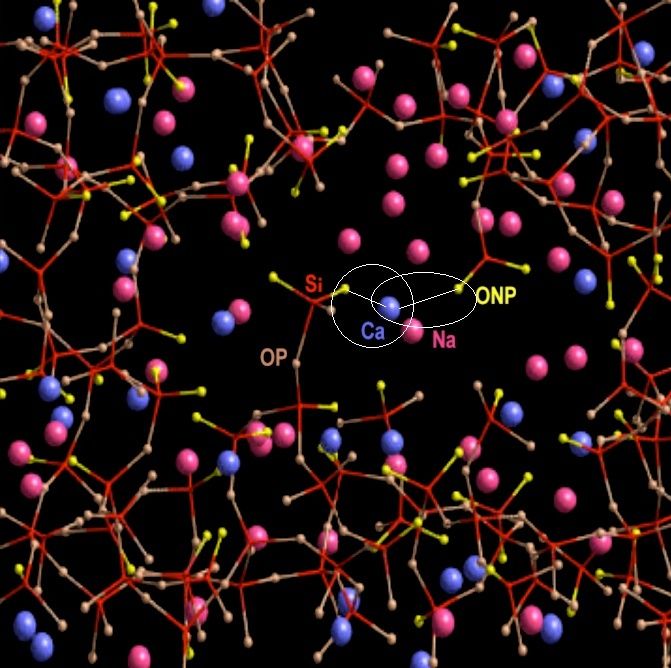
Mes traits droits fins représentent des liaisons électriques de type ionique, pas des liaisons de covalence.
Là-aussi les atomes de calcium ne "flottent" donc pas par hasard dans les lacunes de la structure vitreuse.

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Analyse des vitraux au spectromètre Raman.
Analyse des vitraux au spectromètre Raman.
Une bonne première approche de l'analyse spectrométrique Raman des vitraux dans cette vidéo, avec l'exemple de la Sainte-Chapelle à Paris. Interview de Philippe Colomban, directeur du LADIR. Extrait du Journal des sciences d’avril 2006 :
http://www.cnrs.fr/cw/dossiers/dosart/decouv/00_outils/raman/02_video/01a.html
Ce qui m'intéresse particulièrement dans ce reportage est que la restauration des vitraux de la Sainte-Chapelle semble envisagée en utilisant la potasse comme fondant, afin d'être au plus près de la composition médiévale. On voit bien la différence des bleus du XIIIe et du XIXe siècles. Mais cette différence est elle seulement due aux fondants ?
Le texte du CNRS sur l'analyse des vitraux par spectroscopie Raman :
" Le vitrail est certainement l'innovation la plus importante de l'art médiéval en occident. Comme tout fruit d'une technologie complexe, le verre des vitraux conserve en son sein de multiples informations sur sa fabrication, son histoire et... son vieillissement. Jusqu'à ce jour, les analyses nécessitaient prélèvement et destruction de fragments de vitrail. Les progrès de l'instrumentation et de la compréhension des signatures spectrales ouvrent la voie à des analyses in situ. Deux campagnes de mesures effectuées à la Sainte-Chapelle de Paris en 2005 et 2006 par une équipe mixte Ladir-Lrmh ont validé la méthode.
L'objectif était d'évaluer la possibilité d'effectuer sur site, pour la première fois au monde, une identification non-destructive des types de verres utilisés dans les vitraux à partir de leur signature Raman.
Des travaux récents au Ladir avaient montré qu'il était possible – au laboratoire, avec des spectromètres Raman fixes – de distinguer les verres du Moyen-Age, potassiques, de ceux sodiques, plus ou moins riches en calcium, des verres de remplacement montés au XIXe siècle et de qualifier leur état de dégradation. L'édifice construit par Saint-Louis au XIIIe siècle, à l'intérieur de son Palais, pour abriter les reliques de la Passion du Christ se trouve aujourd'hui dans l'enceinte du Palais de Justice.
Le Ladir avait déjà mené plusieurs campagnes de mesures sur site au Musée National de Céramique (Sèvres) et au Département Islam du Musée du Louvre pour l'analyse de pièces exceptionnelles (Céramiques d'Iznik, Porcelaines des Duc de Médicis, Porcelaines de Böttger (Meissen), vases hispano-mauresques de L'Alhambra,…), dont la rareté et le prix interdisait le transport vers un laboratoire extérieur, et a fortiori des analyses par prélèvement. Les mesures Raman, non destructives, sans contact avec la pièce, la technique étant purement optique, étaient alors effectuées soit dans la salle d'exposition –fermée pour l'occasion au public- soit dans les réserves, c'est-à-dire dans des conditions en fait assez proches de celles du laboratoire (objets propres, pouvant être un peu, manipulés et disposés au mieux pour la mesure avec un certain confort de travail). La principale différence avec les mesures en laboratoire concernait l'instrument : devant être déplacé, le spectromètre Raman devait être beaucoup plus compact, ne comporter aucune pièce mobile pour rester fidèle; le laser devait aussi être facilement transportable. L'analyse sur site utilise une tête optique déportée, liée par deux fibres optiques, l'une pour recevoir du laser la lumière monochromatique, l'autre pour renvoyer sur le spectromètre la diffusion Raman recueillie par l'objectif de microscope, servant à la fois à l'illumination de l'objet et à la collection de la lumière diffusée. Les grossissements possibles sont compris typiquement entre 10 et 1000 fois, c'est-à-dire avec des spots lasers respectivement de quelques mm2 ou de quelques microns2. Dans cette tête un filtre spécial élimine la lumière du laser rediffusée ne portant donc pas d'informations sur le matériau éclairé pour ne conserver que celle qui contient des informations sur la composition du verre mais aussi sur sa technologie et son état de conservation.
L'opération "Raman Sainte-Chapelle" comportait plusieurs difficultés inédites qui ont été résolues avec l’aide d’un fabriquant d’instrument (la Société Horiba-Jobin-Yvon), de Mmes Boucher et Clavel, administrateurs de la Sainte-Chapelle, et de leur personnel, ainsi que du Commandement Militaire :
•L'accès de la Chapelle haute et de sa verrière de 600m2 de vitraux, dont environ les 2/3 sont estimés originaux dans l'état des connaissances par examen visuel ou selon la documentation, se fait par une volée d'escaliers en pierre Moyen-âgeux (d’une largeur d’environ 60 cm). Il est heureusement possible d'approcher le bas des verrières de l'abside, dont celle dite de Saint-Jean Baptiste, récemment nettoyée, par l' escalier à vis permettant de monter sur la tribune des Reliques.
• L'accès de la Rosace, refaite au XVe siècle, la nature des vitraux y étant quasi-inconnue, est possible par une autre volée d'escaliers, non éclairés ! La galerie sous la Rosace avait été équipée d'une unique prise électrique pour la pose des capteurs VIDRIO.
La Société Horiba-Jobin-Yvon mettait à notre disposition un "mécano" transportable comprenant :
•un laser vert (532nm) délivrant plusieurs dizaines de mW (poids environ 5 kg)
•une tête optique et un jeu de 2 fois 10 mètres de fibres optiques (poids environ 1 kg)
•un tout nouveau spectromètre, l'Axial 532 ( poids environ 15 kg), à prisme gravé et tête de détection CCD refroidie à –70°C par effet Peltier. Conçu pour le contrôle des composants microélectroniques, cet instrument a été modifié pour s'adapter à nos besoins.
L'équipement de mesure comprenait en outre 25 mètres de rallonge électrique, des multiprises, un ordinateur portable, des objectifs de grossissements et focales variés permettant de travailler plus ou moins collé au verre, un support XYZ à déplacements micrométriques dans les trois directions de l'espace, un pied photographique à rotule orientable modifié, un boy, des poids de stabilisation, des plaques d’aluminium pour réaliser des supports, du tissu noir, etc.
Les questions auxquelles l'opération Raman Sainte-Chapelle tentait de répondre étaient :
•est-il possible d'installer et de travailler avec ce nouvel instrument portable dans des lieux difficiles d'accès ?
•faut-il mieux travailler à l'intérieur ou à l'extérieur ? Les conditions de pollutions et de salissures des vitraux sont différentes comme l’est également la perturbation par la lumière ambiante, importante dans une analyse depuis l'intérieur le jour, beaucoup plus faible dans le cas d'une mesure sur les faces extérieures.
•quels types de verres donnent une signature "exploitable" dans les conditions de travail ?
•quels sont les objectifs les plus favorables sachant qu' un fort grossissement favorise la concentration de lumière mais son positionnement est pointu et nécessite une parfaite stabilité et qu'un objectif à courte distance focale limite la lumière parasite mais le spot est difficilement visible ?
Les mesures faites principalement sur les verres bleus et verts ont montré qu'il était possible de reconnaître les verres potassiques, donc médiévaux, de certains verres de remplacement du XIXe siècle, en particulier ceux utilisant le chrome.
Ces premières campagnes ont permis de bien définir la procédure à employer pour de nouvelles campagnes, de nouveau à la Sainte-Chapelle, mais aussi à la Cathédrale Saint-Denis.
Sites :
•Laboratoire de Dynamique, Intéractions et Réactivité [LADIR] (unité mixte de recherche CNRS/Université Paris 6)
•Laboratoire de recherches des monuments historiques (Ministère de la culture et de la communication)."
Source : CNRS : http://www.cnrs.fr/cw/dossiers/dosart/decouv/00_outils/raman/accueil_raman.html

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 XIIe siècle : Le fameux moine Théophile et les vitraux.
XIIe siècle : Le fameux moine Théophile et les vitraux.
Varions un peu les plaisirs, avec un peu d'exploration historique médiévale après ces quelques posts un peu scientifiques. Commençons par cet article : Le chapitre XXVIII de la Schedula du moine Théophile: technique et esthétique du vitrail roman.
Source : Comptes rendus des séances de l'Académie des Inscriptions et Belles-Lettres, article de Louis Grodecki.
http://www.persee.fr/doc/crai_0065-0536_1976_num_120_2_13258
Extraits choisis, en début d'article :
"Tous les historiens de la technologie médiévale, et tous les historiens de l'art, connaissent la Schedula diversarum artium d'un moine Théophile, texte conservé en six manuscrits anciens, répartis entre les bibliothèques d'Europe. Ils datent du XIIe siècle (Vienne, Wolfenbùttel) au XVe."
"[Les] historiens qui sont, maintenant, plus ou moins d'accord pour reconnaître qu'il s'agit d'un écrit du début ou de la première moitié du XIIe siècle (et non du Xe comme on l'a pensé) et qu'il est de provenance germanique, ainsi que le montrent certains germanismes du vocabulaire latin de l'écrivain."
"le second livre — incomplet — concerne la fabrication du verre, des vases creux, du verre plat et, à partir de celui-ci, de la confection des vitraux. Les indications technologiques de Théophile sont, en général, d'une valeur exceptionnelle : on peut (et on l'a fait) construire les fours de fusion, de refroidissement et de recuisson du verre en suivant les données du texte [ là il faut trouver des exemples de réalisations de tels fours, et des données sur les températures obtenues] ; il est plus malaisé de l'utiliser pour « composer » la matière du verre, en raison des difficultés du vocabulaire et de ses lacunes [ Dommage...]. Par contre, les chapitres sur la composition et l'application de la « grisaille » — c'est-à-dire de la peinture vitrifiable au four de recuisson — et ceux sur la mise en plomb, sont d'une exactitude parfaite."
Et ici : http://www.universalis.fr/encyclopedie/theophile-le-moine/ :
"On a tenté de deviner la personnalité de Théophile à partir de son œuvre : on sait que Théophile, de son vrai nom Rogerus, était moine, sans doute bénédictin, et prêtre, qu'il vivait dans le nord-est de la Germanie, durant la première moitié du XIIe siècle, peut-être en relation avec le milieu de la cour impériale. Bien qu'il comporte une part de compilation, son livre révèle un homme d'un grand sens pratique, ayant une connaissance personnelle des techniques qu'il décrit et remettant en question ses connaissances à la lumière de sa propre expérience."
Là on a donc de sérieuses pistes à creuser. Alors à plus tard pour la suite !

Northman- Messages : 547
Date d'inscription : 17/05/2015
Age : 62
Localisation : Normandie
 Sujets similaires
Sujets similaires» Norvège : Les "stavkirke", églises en "bois debout", et secondairement bien d'autres aspects de ce magnifique pays et de sa culture...
» Une recherche sur le magnifique "bleu de Chartres".
» Une recherche sur le magnifique "bleu de Chartres".
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum